Nytta/risk-värdering av COX-hämmare
COX-hämmare (NSAID) är mycket effektiva vid behandling av nociceptiv smärta både med och utan inflammation. Vid ekvipotenta doser är det inga större skillnader i analgetisk effekt mellan de olika preparaten. Valet av läkemedel baseras därför på säkerhetsprofil och samsjuklighet. Naproxen rekommenderas på grund av en mera fördelaktig kardiovaskulär riskprofil jämfört med övriga preparat i gruppen COX-hämmare. Till patienter med en hög risk för gastrointestinala biverkningar (GI) rekommenderas en låg dos av celecoxib (200 mg/dygn) på grund av låg risk för GI-biverkningar och en lägre risk för kardiovaskulära händelser jämfört med andra coxiber.
Icke steroida antiinflammatoriska läkemedel ofta refererat till som NSAID, för engelskans ”Non-Steroidal Anti-Inflammatory Drugs”, hämmar enzymet cyclooxygenas (COX).
Det finns två varianter av COX; COX-1 som uttrycks konstitutivt i de flesta celler och COX-2 som induceras vid inflammation. Såväl COX-1 som COX-2 bildar prostaglandiner, som ökar smärtsignaleringen såväl i periferin som i ryggmärgens bakhorn [1]. Expressionen av COX-2 är mer cellspecifik än COX-1. Exempelvis uttrycker trombocyter inte COX-2, men innehåller COX-1 och är effektiva i att bilda tromboxan [2]. Proteinexpressionen skiljer sig också i olika celler i njuren med betydelse för effekter av COX-hämmare på njurfunktion [3].
I nedanstående text används uttrycket COX-hämmare på alla läkemedel som hämmar COX, och innefattar såväl preparat som är mera COX-2-selektiva (COX-2-hämmare) som preparat som hämmar COX-1 och COX-2 i nästan samma utsträckning (oselektiva COX-hämmare). Figur 1 illustrerar till vilken grupp de olika preparaten hör.
Inom läkemedelsgruppen COX-hämmare finns ett stort antal preparat, varav flera är registrerade i Sverige. Perorala beredningar: naproxen, diklofenak, ibuprofen, etoricoxib, ketoprofen, celecoxib, dexibuprofen, nabumeton, meloxikam, naproxen med esomeprazol, tenoxikam, piroxikam, och indometacin. Utöver dessa perorala beredningar finns ibuprofen, ketorolak och parecoxib för injektionsbruk. För några substanser (till exempel ketoprofen, diklofenak) finns även topikala beredningar, som dock ligger utanför läkemedelsförmånssystemet. Till gruppen analgetika hör även acetylsalicylsyra (ASA) och paracetamol, som också är prostaglandinsynteshämmare.
På Kloka listan 2022 rekommenderas naproxen, ibuprofen, ketoprofen, och celecoxib.
Rekommendationer i Kloka listan »
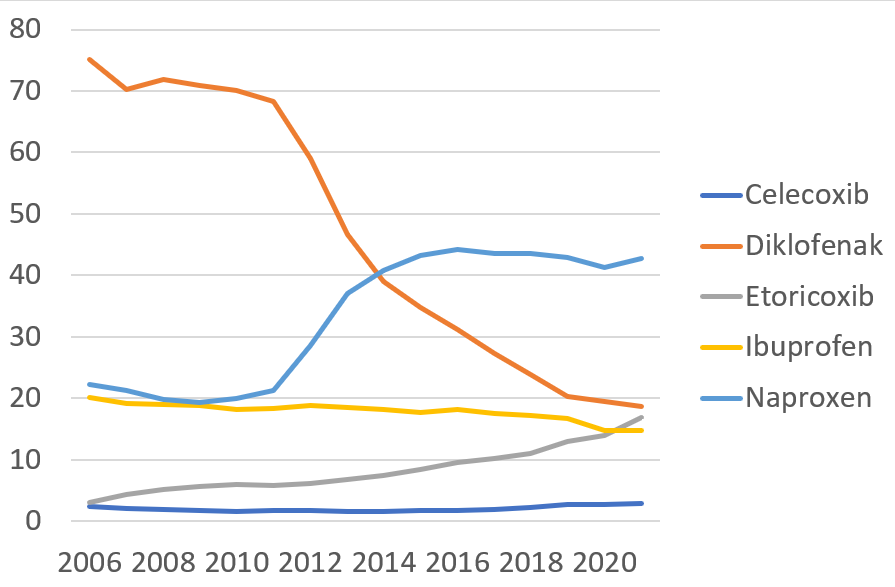
Diagrammet visar antalet individer per 1 000 invånare som hämtat ut recept på olika COX-hämmare i Region Stockholm. Källa Socialstyrelsen.
1. Selektivitet för COX-1 och COX-2
Naproxen och ibuprofen är något mer effektiva i att hämma COX-1 än COX-2, till skillnad från till exempel diklofenak och celecoxib som är något mera effektiva i att hämma COX-2 [4, 5]. Som jämförelse hämmar acetylsalicylsyra COX-1 vid en plasmakoncentration omkring 10 mikromolar medan 10–100 gånger högre koncentration krävs för att blockera COX-2.
Skillnader i dos-effekt samband och grad av biverkningar från magtarmkanalen och hjärtkärlsystemet är föremål för intensiv forskning. Farmakokinetiska och farmakodynamiska faktorer med olika grad av hämning av COX-1 respektive COX-2 anses vara av betydelse i detta avseende. Även patientspecifika faktorer är av betydelse och det är vanligt att ett visst preparat inte tolereras av en patient, medan ett annat kan fungera såväl effektmässigt som biverkningsmässigt. Eftersom selektiva COX-2-hämmare och oselektiva COX-hämmare har en liknande effekt avseende smärthämning, baseras valet av behandling av säkerhetsprofilen inklusive kardiovaskulära och gastrointestinala (GI) riskfaktorer samt samsjuklighet. Efter en genomgång av evidensläget rekommenderas naproxen i första hand på grund av en mer fördelaktig kardiovaskulär riskprofil jämfört med de andra COX-hämmarna. Expertgruppens generella preparatrekommendationer avser inte patienter med en hög kardiovaskulär risk. Till patienter med hög risk för gastrointestinala biverkningar rekommenderas en låg dos av celecoxib (200 mg/dygn) på grund av låg risk för GI-biverkningar och en lägre risk för kardiovaskulära händelser jämfört med andra coxiber [6].
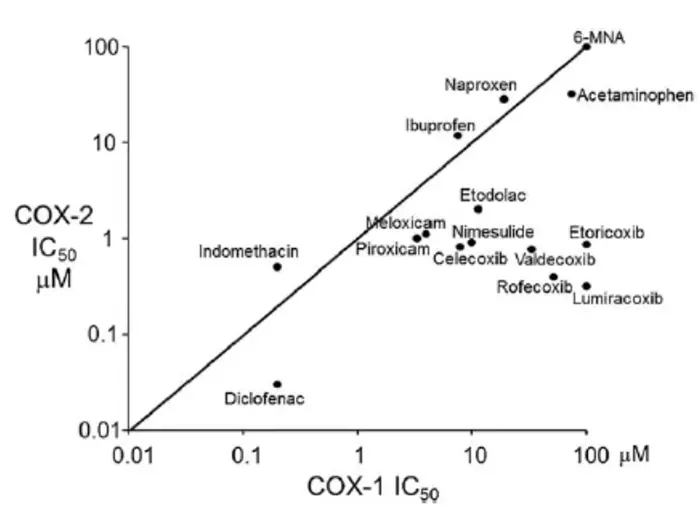
Figur 1. Concentrations of various drugs required to inhibit the activity of cyclooxygenase (COX)-1 and COX-2 byg 50% (IC50) in human whole-blood assays. Each point is the mean of three of four determinations. Drugs plotted below the diagonal line indicating equivalence are more potent inhibitors of COX-2 than COX-1. 6-MNA denotes 6-methoxy-2-naphthylacetic acit, the active metabolite of nabumetone. Modified and uppdated from FitzGerald and Patrono, N Engl J Med 2001;345,433-442.
2. Effekt mot akut smärta
COX-hämmare (NSAID) är mycket effektiva vid behandling av nociceptiv smärta såväl med som utan inflammation. Under förutsättning att ekvipotenta doser har använts föreligger inga större skillnader avseende analgetisk effekt mellan de olika preparaten [7, 8].
En metaanalys av postoperativ smärta redovisar number needed to treat (NNT) för att uppnå en minst 50-procentig smärtlindring under 4–6 timmar [9]. Den mest omfattande dokumentationen (6 475 deltagare/61 studier) föreligger för ibuprofen 400 mg med NNT 2,5 (95 % KI 2,4–2,6). För naproxen 500 mg eller 550 mg (784 deltagare/9 studier) anges NNT 2,7 (2,2–3,5). För celecoxib 200 mg (705 deltagare/4 studier) anges NNT 4,2 (3,4–5,6) och för celecoxib 400 mg (722 deltagare/5 studies) anges NNT 2,6 (2,3–3,0). För etoricoxib 120 mg (798 deltagare/6 studier) anges NNT 1,8 (1,7–2,0). En liknande effekt som med etoricoxib noteras även för kombinationen ibuprofen 400 mg och paracetamol 1 000 mg (543 deltagare/3 studier) med NNT 1,5 (1,4–1,7).
3. Effekt vid artros
En Cochrane metaanalys avseende celecoxib inkluderade 36 studier med 17 206 deltagare med artros [10]. Tyvärr saknade författarna till denna systematiska översikt studiedata för 15 538 deltagare i tre studier. Jämfört med placebo noterades tre-procentig absolut och tolv-procentig relativ förbättring avseende en 500-poängs WOMAC-skala. Jämfört med COX-hämmare som hämmar såväl COX-1 som COX-2 noterades inga skillnader på en 100-gradig VAS-skala. En liten sex-procentig absolut funktionsförbättring på en 100-gradig WOMAC skala noterades för celecoxib jämfört med NSAID-preparat.
I två randomiserade studier med initialt 997 patienter med knä- eller höftartros med förlängning till 138 veckor, noterades ingen effektskillnad avseende WOMAC-pain, WOMAC-fysisk funktion eller patientens globalskattning mellan etoricoxib 60 mg och naproxen 500 mg x 2 [11].
4. Effekt vid reumatoid artrit
En Cochrane metaanalys av celecoxib vid reumatoid artrit (RA) redovisar effektmåttet ACR20 [12]. De inkluderade studierna hade en duration mellan 6 och 24 veckor. Den relativa effekten avseende ACR20 mellan jämförelsepreparaten naproxen, diklofenak och nabumeton var 1,1 (95 % KI: 0,99–1,23). Någon statistiskt signifikant skillnad mellan celecoxib 200 mg eller 400 mg förelåg varken i jämförelse med naproxen 1 000 mg/dygn (RR 1,16; 95 % KI: 0,94–1,42), diklofenak (RR 1,04; 95 % KI: 0,89–1,22) eller nabumeton 1 000 mg/dygn (RR 1,08; 95%: KI 0,89–1,30). Jämförande studier som redovisar ACR för ibuprofen i jämförelse mot celecoxib saknas.
En randomiserad dubbelblind tolvveckorsstudie på 891 patienter med RA redovisar ett behandlingssvar med ACR20 hos 59 procent med etoricoxib 90 mg/dygn, 58 procent med naproxen 1 000 mg/dygn och 41 procent med placebo [13]. Även i en 121-veckorsstudie som inkluderade 816 patienter med RA noterades inga skillnader avseende minskning i ACR mellan etoricoxib 90 mg eller 120 mg och naproxen 1 000 mg [14].
5. Risk för kardiovaskulära händelser
Den allvarligaste biverkan vid NSAID-behandling är utan tvekan den ökade risken för allvarlig hjärtkärlpåverkan. I de tidiga studierna mellan rofecoxib och naproxen noterades en lägre risk för kardiovaskulära händelser med naproxen jämfört med rofecoxib. Den potentiella risken med COX-2-selektiva hämmare blev tydlig i placebokontrollerade långtidsstudier (tre år) på patienter med familiär kolonpolypos, APC-studien med celecoxib och APPROVe-studien med rofecoxib.
I APC-studien (Adenoma Prevention with Celecoxib) med celecoxib inkluderades 2 035 patienter. Risken för kardiovaskulär död eller icke-dödlig hjärtinfarkt var 1,9/1 000 patientår med placebo jämfört med 5,8/1 000 patientår med celecoxib 200 mg x 2 och 7,4/1 000 patientår med celecoxib 400 mg x 2 [15].
I APPROVe-studien (Adenomatous Polyp Prevention On Vioxx) inkluderades 2 586 patienter som följdes under tre år. Det noterades kardiovaskulära händelser, som även inkluderar instabil angina pectoris, hos 0,36/100 patientår (3,6/1 000 patientår) med placebo och 1,01/100 patientår (10,1/1 000 patientår) med rofecoxib 25 mg/dygn [16]. I efterförloppet till APPROVe-studien avregistrerades rofecoxib av tillverkaren MSD över hela världen.
Samma tillverkare som hade tagit fram rofecoxib hade även utvecklat etoricoxib, en COX-2-hämmare som liknar rofecoxib och som marknadsförs i Europa (EMA). Den amerikanska läkemedelsmyndigheten FDA däremot ansåg däremot att etoricoxib inte skulle godkännas för den amerikanska marknaden.
Flera epidemiologiska studier pekar mot en ökad risk för kardiovaskulära händelser med COX-2-selektiva hämmare såsom rofecoxib, celecoxib eller diklofenak, jämfört med naproxen eller en kontrollgrupp [17-21].
Den kardiovaskulära riskprofilen för coxiber ansågs vara direkt kopplad till COX-2-selektiviteten. Men såväl selektiva COX-2-hämmare som oselektiva NSAID (nsNSAID) är associerade med en ökad risk för kardiovaskulära händelser [7, 8].
Under 2016 och 2017 publicerades två stora randomiserade kliniska studier PRECISION och SCOT. I PRECISION jämfördes celecoxib (genomsnittsdos 209 mg/dygn) med ibuprofen (genomsnittsdos 2 045 mg/dygn) och naproxen (genomsnittsdos 842 mg/dygn) på 24 081 patienter som följdes under 30 månader [22]. Avseende huvudeffektmåttet APTC criteria (kardiovaskulär död, inkluderande blödning med dödlig utgång, icke-dödlig hjärtinfarkt eller icke-dödlig stroke) noterades ingen statistiskt signifikant skillnad mellan dessa tre grupper. Däremot noterades färre allvarliga gastrointestinala biverkningar med celecoxib i denna studie.
I SCOT inkluderades 7 297 patienter utan etablerad kardiovaskulär sjukdom med pågående behandling med icke-selektiva COX-hämmare (diklofenak 39 %, ibuprofen 32 %) [23]. Patienterna randomiserades till att byta till celecoxib eller till att fortsätta med sin behandling. Huvudeffektmåttet i denna studie var sjukhusvård för icke-dödlig hjärtinfarkt, eller positiva biomarkörer för akut koronart syndrom, icke-dödlig stroke eller kardiovaskulär död. Dessa händelser noterades hos 1,14/100 patientår med celecoxib jämfört med 1,1/100 patientår i kontrollgruppen som fortsatte med tidigare behandling. I gruppen som randomiserades till celecoxib noterades färre allvarliga gastrointestinala biverkningar och hematologiska biverkningar. Fler patienter avbröt behandling med celecoxib (50,9 %) än med icke selektiva COX-hämmare (30,2 %).
I en nätverksmetaanalys av 176 studier med mer än 140 000 patienter med reumatoid artrit eller artros jämfördes diklofenak med ibuprofen, naproxen, celecoxib och etoricoxib avseende effekt, säkerhet och tolerabilitet [24]. Samtliga preparat medförde en betydelsefull smärtlindring, funktionsförbättring och välbefinnande. Någon ökad risk för kardiovaskulära biverkningar med diklofenak noterades inte i denna analys. Risken för studieavbrott med diklofenak var lägre än för ibuprofen, jämförbar med celecoxib och naproxen, men högre än för etoricoxib.
I en metaanalys av 26 randomiserade kontrollerade studier och prospektiva kohortstudier med sammanlagt 228 000 individer undersöktes tre nsNSAIDs (ibuprofen, diklofenak, naproxen) och fem coxiber (meloxikam, etoricoxib, celecoxib, lumiracoxib och rofecoxib) avseende kopplingen mellan kardiovaskulär risk och COX-2-selektivitet [25]. Huvudeffektmåttet inkluderade hjärtinfarkt (MI), stroke, kardiovaskulär död och en kombination av dessa (composite CV outcome). Rofecoxib var den enda coxiben med ökade kardiovaskulära biverkningar. För andra coxiber noterades ingen skillnad mot placebo eller nsNSAID som grupp. För celecoxib noterades till och med en något lägre risk för stroke jämfört med nsNSAID.
I detta sammanhang kan det vara viktigt att påpeka den dosberoende ökningen av kardiovaskulära händelser som har noterats i randomiserade studier som använde sig av olika doser [15] och i epidemiologiska undersökningar [17-21].
Den allmänt accepterade mekanismen bakom den kardiovaskulära toxiciteten av coxiber är en minskning av endotelcellers prostacyklinproduktion, som är kärlskyddande, medan trombocyters produktion av tromboxan fortgår [2, 15]. Endotelceller uttrycker såväl COX-1 som COX-2 medan trombocyter uttrycker endast COX-1. I analogi är förklaringsmodellen för den hjärtkärlskyddande effekten av lågdos acetylsalicylsyra (ASA) hämning av trombocyternas tromboxanproduktion medan endotelcellernas produktion av prostacyklin förblir opåverkad [26]. Fördelen med lågdos ASA är att trombocyternas COX-1 hämmas direkt och irreversibelt efter absorption ifrån magtarmkanalen. Endast de ASA-molekyler som inte har bundit till trombocyter metaboliseras i levern i samband med första passage effekten och mängden ASA som når systemkretsloppet blir låg. Nya rön talar dock för att påverkan av njurar kan vara underskattade som förklaringsmodell [27]. COX-2-hämning har nyligen visats påverka ADMA systemet i njurar. ADMA är en förkortning av asymmetrisk dimetylarginin vilket är en aminosyra som reglerar mängden kväveoxid i blodet. Vid COX-2-hämning stiger ADMA i blodet, som via hämning av NO-systemet påverkar kärlen i negativ riktning.
6. Risk för död med COX-hämmare, epidemiologiska studier ifrån Danmark
I stora epidemiologiska studier på friska individer [17], på patienter med hjärtsvikt [19] och på patienter efter en hjärtinfarkt [18] är risken för död eller hjärtinfarkt ökad för COX-2- hämmare och diklofenak, men inte för naproxen (Tabell 2–5).
Preparat | Död per 1 000 patientår (95 % konfidensintervall) |
|---|---|
Kontroll utan NSAID | 8 (8–8) |
Naproxen | 9 (8–11) |
Ibuprofen | 11 (10–11) |
Diklofenak | 18 (17–19) |
Celecoxib | 51 (45–57) |
Rofecoxib | 50 (44–57) |
Preparat | Död per 1 000 patientår (95 % konfidensintervall) |
|---|---|
Kontroll utan NSAID | 18 (18–18) |
Naproxen | 12 (5–19) |
Ibuprofen | 16 (13–19) |
Diklofenak | 31 (25–38) |
Celecoxib | 68 (41–95) |
Rofecoxib | 87 (59–116) |
Preparat | Död per 1 000 patientår (95 % konfidensintervall) |
|---|---|
Kontroll utan NSAID | 218 (216–220) |
Naproxen | 237 (211–263) |
Ibuprofen | 236 (228–245) |
Diklofenak | 308 (292–324) |
Celecoxib | 288 (271–305) |
Rofecoxib | 329 (310–347) |
Preparat | Död per 1 000 patientår (95 % konfidensintervall) |
|---|---|
Kontroll utan NSAID | 95 (94–97) |
Ibuprofen | 117 (105–131) |
Diklofenak | 137 (117–160) |
Celecoxib | 165 (137–198) |
Rofecoxib | 169 (144–198) |
Andra NSAID | 102 (92–113) |
7. Risk för stroke
En metaanalys av tio observationella studier analyserade associationen mellan hemorragiskt stroke och användningen av NSAID [28]. Som grupp noterades ingen ökad risk för hemorragisk stroke men en liten riskökning noterades för diklofenak och meloxikam.
Enligt en epidemiologisk studie från Danmark på 1 028 437 friska individer [29] medför hög dos ibuprofen (>1 200 mg/dygn) och diklofenak en ökad risk för ischemisk stroke med hazardkvot HR 2,15 (95 % KI: 1,66–2,79) respektive 2,37 (1,99–2,81). I gruppen som erhöll ibuprofen 301 001 individer (98 893 personår) noterades 367 fall av ischemisk stroke (number needed to harm, NNH 438). Av 172 362 individer (33 007 personår) med diklofenak noterades 177 fall av ischemisk stroke (NNH 254). För rofecoxib med 16 079 individer (4 920 personår) noterades 34 fall av stroke (NNH 182) och för celecoxib med 15 599 individer (4 885 personår) noterades 37 fall av stroke (NNH 163). På grund av ett fåtal stroke-händelser är siffrorna för rofecoxib och celecoxib osäkra. För naproxen som användes av 40 904 individer (14 963 personår) noterades 46 fall av stroke, vilket motsvarar ett NNH på 608. Avseende risken för hemorrhagisk stroke noterades en association endast för diklofenak och naproxen, med dessa beräkningar är osäkra på grund av få händelser.
8. Risk för blödning vid samtidig behandling med warfarin
Enligt en fall-kontrollstudie ifrån Kanada så ökar COX-2-hämmare (celecoxib/rofecoxib) risken för hospitalisering på grund av övre GI-blödning på patienter över 66 år som behandlas med warfarin. Denna riskökning är i samma storleksordning som med icke selektiva NSAID [30]. Det finns fallbeskrivningar på patienter som behandlades med warfarin där celecoxib resulterade i kraftigt ökade INR och blödningar [31]. Denna risk kan variera eftersom andra studier inte kunde påvisa denna interaktion [32] eller pekar mot en liten interaktion som sannolikt saknar klinisk betydelse [33].
Enligt Fass bör ”koagulationsparametrar följas hos patienter som behandlas med warfarin eller andra antikoagulantia, speciellt de första dagarna efter insättandet eller vid förändrad dosering av celecoxib, eftersom dessa patienter löper ökad risk för blödningskomplikationer.
9. Risk för njurpåverkan
Prostaglandiner fyller en viktig funktion för att upprätthålla den glomerulära filtrationen [34] och såväl oselektiva NSAID preparat som coxiber kan resultera i akut njursvikt [35]. Samtidig behandling med ACE-hämmare eller intorkning ökar risken för denna biverkan [36].
10. Risk för ulcus och allvarliga gastrointestinala komplikationer
När de COX-2-selektiva preparaten lanserades lyfte man fram det faktum att risken för ulcus var lägre än för de oselektiva preparaten. I de initiala studierna med VIGOR [37] med rofecoxib och CLASS [38] med celecoxib noterades färre endoskopiska ulcerationer jämfört med naproxen, respektive diklofenak och ibuprofen. Skillnaden avseende risken för kliniskt signifikanta ulcerationer var dock mindre vid fokus på allvarliga ulcerationer och avseende detta utfall förelåg ingen signifikant fördel för celecoxib jämfört med diklofenak och ibuprofen [39, 40]. Det som också framgick i dessa studier var att samtidigt intag av lågdos ASA ökar risken för ulcus såväl hos patienter som använder oselektiva som selektiva COX-hämmare och vid långtidsbehandling med lågdos ASA och andra NSAID rekommenderas ulcusprofylax (magskydd) med omeprazol [41, 42].
I jämförelse med oselektiva NSAID har COX-2-hämmare en signifikant fördel i patient-gruppen med tidigare allvarliga gastrointestinala komplikationer, såsom perforationer, ulkus eller blödningar från magsäcken. En systematisk genomgång av observationella studier publicerade mellan åren 2000 och 2008 [43] anger en relativ risk (RR) på 4,5 (95 % KI: 3,82–5,31) för övre GI-blödning eller perforation med icke selektiva NSAID jämfört med en kontrollgrupp utan NSAID. För gruppen COX-2-selektiva hämmare var den RR 1,88 (95 % KI: 0,96–3,71). De mest relevanta riskfaktorerna för GI-biverkningar är tidigare magsår, hög ålder och samtidig användning av lågdos ASA. COX-2-selektiva preparat har en liknande effekt, men med lägre GI-toxicitet än oselektiva NSAID såväl avseende övre GI som nedre GI-komplikationer [44]. Även i den randomiserade PRECISION-studien var risken för allvarliga gastrointestinala biverkningar lägre med celecoxib jämfört med ibuprofen 0,65 (95% CI 0,5–0,85). Jämfört med naproxen var risken 0,71 (0,54–0,93) [45]. Till patienter med en mycket hög risk för gastrointestinala biverkningar rekommenderas kombinationen celecoxib med protonpumpshämmare (PPI) [46].
11. Risk för blödning i samband med kirurgi
COX-2-hämmare påverkar inte trombocyternas tromboxansyntes och enligt en metaanalys ökar COX-2-hämmare varken risken för intra- eller postoperativa blödningar [47]. I detta sammanhang kan det vara bra att lyfta fram att inte heller metaanalyser på oselektiva COX-hämmare såsom ketorolak [48] eller ibuprofen [49] pekar mot en ökad blödningsrisk. Även en systematisk översikt av 36 tonsillektomistudier på 1 446 vuxna eller 1 747 barn kunde inte heller påvisa någon ökad blödningsrisk med NSAID jämfört med placebo [50].
Region Stockholms läkemedelskommittés expertgrupp för smärta och reumatiska sjukdomar
Källa
- Yaksh TL, Dirig DM, Malmberg AB. Mechanism of action of nonsteroidal anti-inflammatory drugs. Cancer Invest. 1998;16(7):509-27
- Patrono C, Baigent C. Coxibs, Traditional NSAIDs, and Cardiovascular Safety Post-PRECISION: What We Thought We Knew Then and What We Think We Know Now. Clin Pharmacol Ther. 2017 Aug;102(2):238-245
- Hörl WH. Nonsteroidal Anti-Inflammatory Drugs and the Kidney. Pharmaceuticals (Basel). 2010 Jul 21;3(7):2291-2321
- Patrignani P, Patrono C. Cyclooxygenase inhibitors: From pharmacology to clinical read-outs. Biochim Biophys Acta. 2015 Apr;1851(4):422-32
- FitzGerald GA, Patrono C. The coxibs, selective inhibitors of cyclooxygenase-2. N Engl J Med. 2001 Aug 9;345(6):433-42
- Pelletier JP, Martel-Pelletier J, Rannou F, Cooper C. Efficacy and safety of oral NSAIDs and analgesics in the management of osteoarthritis: Evidence from real-life setting trials and surveys. Semin Arthritis Rheum. 2016 Feb;45(4 Suppl):S22-7
- Brune K, Patrignani P. New insights into the use of currently available non-steroidal anti-inflammatory drugs. J Pain Res. 2015 Feb 20;8:105-18. PubMed
- Conaghan PG. A turbulent decade for NSAIDs: update on current concepts of classification, epidemiology, comparative efficacy, and toxicity. Rheumatol Int. 2012 Jun;32(6):1491-502
- Moore RA, Derry S, Aldington D, Wiffen PJ. Single dose oral analgesics for acute postoperative pain in adults - an overview of Cochrane reviews. Cochrane Database Syst Rev. 2015 Sep 28;(9):CD008659
- Puljak L, Marin A, Vrdoljak D, Markotic F, Utrobicic A, Tugwell P. Celecoxib for osteoarthritis. Cochrane Database Syst Rev. 2017 May 22;5:CD009865
- Reginster JY, Malmstrom K, Mehta A, Bergman G, Ko AT, Curtis SP, Reicin AS. Evaluation of the efficacy and safety of etoricoxib compared with naproxen in two, 138-week randomised studies of patients with osteoarthritis. Ann Rheum Dis. 2007 Jul;66(7):945-51
- Fidahic M, Jelicic Kadic A, Radic M, Puljak L. Celecoxib for rheumatoid arthritis. Cochrane Database Syst Rev. 2017 Jun 9;6:CD012095
- Collantes E, Curtis SP, Lee KW, Casas N, McCarthy T, Melian A, et al. A multinational randomized, controlled, clinical trial of etoricoxib in the treatment of rheumatoid arthritis [ISRCTN25142273]. BMC Fam Pract. 2002 May 22;3:10
- Matsumoto A, Melian A, Shah A, Curtis SP. Etoricoxib versus naproxen in patients with rheumatoid arthritis: a prospective, randomized, comparator-controlled 121-week trial. Curr Med Res Opin. 2007 Sep;23(9):2259-68
- Solomon SD, McMurray JJ, Pfeffer MA, Wittes J, Fowler R, Finn P, et al. Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med. 2005 Mar 17;352(11):1071-80
- Bresalier RS, Sandler RS, Quan H, Bolognese JA, Oxenius B, Horgan K, et al. Adenomatous Polyp Prevention on Vioxx (APPROVe) Trial Investigators. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl J Med. 2005 Mar 17;352(11):1092-102
- Fosbøl EL, Gislason GH, Jacobsen S, Folke F, Hansen ML, Schramm TK, et al. Risk of myocardial infarction and death associated with the use of nonsteroidal anti-inflammatory drugs (NSAIDs) among healthy individuals: a nationwide cohort study. Clin Pharmacol Ther. 2009 Feb;85(2):190-7
- Gislason GH, Jacobsen S, Rasmussen JN, Rasmussen S, Buch P, Friberg J, et al. Risk of death or reinfarction associated with the use of selective cyclooxygenase-2 inhibitors and nonselective nonsteroidal antiinflammatory drugs after acute myocardial infarction. Circulation. 2006 Jun 27;113(25):2906-13
- Gislason GH, Rasmussen JN, Abildstrom SZ, Schramm TK, Hansen ML, Fosbøl EL, et al. Increased mortality and cardiovascular morbidity associated with use of nonsteroidal anti-inflammatory drugs in chronic heart failure. Arch Intern Med. 2009 Jan 26;169(2):141-9
- Sondergaard KB, Weeke P, Wissenberg M, Schjerning Olsen AM, Fosbol EL, Lippert FK, et al. Non-steroidal anti-inflammatory drug use is associated with increased risk of out-of-hospital cardiac arrest: a nationwide case-time-control study. Eur Heart J Cardiovasc Pharmacother. 2017 Apr 1;3(2):100-107
- Sørensen R, Abildstrom SZ, Torp-Pedersen C, Gislason GH. Use of selective cyclooxygenase-2 inhibitors and nonselective nonsteroidal antiinflammatory drugs in high doses increases mortality and risk of reinfarction in patients with prior myocardial infarction. J Cardiovasc Nurs. 2008 Jan-Feb;23(1):14-9
- Nissen SE, Yeomans ND, Solomon DH, Lüscher TF, Libby P, Husni ME, et al. Cardiovascular Safety of Celecoxib, Naproxen, or Ibuprofen for Arthritis. N Engl J Med. 2016 Dec 29;375(26):2519-29
- MacDonald TM, Hawkey CJ, Ford I, McMurray JJV, Scheiman JM, Hallas J, et al. Randomized trial of switching from prescribed non-selective non-steroidal anti-inflammatory drugs to prescribed celecoxib: the Standard care vs. Celecoxib Outcome Trial (SCOT). Eur Heart J. 2017 Jun 14;38(23):1843-1850
- van Walsem A, Pandhi S, Nixon RM, Guyot P, Karabis A, Moore RA. Relative benefit-risk comparing diclofenac to other traditional non-steroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors in patients with osteoarthritis or rheumatoid arthritis: a network meta-analysis. Arthritis Res Ther. 2015 Mar 19;17:66
- Gunter BR, Butler KA, Wallace RL, Smith SM, Harirforoosh S. Non-steroidal anti-inflammatory drug-induced cardiovascular adverse events: a meta-analysis. J Clin Pharm Ther. 2017 Feb;42(1):27-38
- Catella-Lawson F. Vascular biology of thrombosis: platelet-vessel wall interactions and aspirin effects. Neurology. 2001;57(5 Suppl 2):S5-7
- Ricciotti E, Castro C, Tang SY, Briggs WTE, West JA, Malik D, et al. Cyclooxygenase-2, Asymmetric Dimethylarginine, and the Cardiovascular Hazard From Nonsteroidal Anti-Inflammatory Drugs. Circulation. 2018 Nov 20;138(21):2367-2378
- Ungprasert P, Matteson EL, Thongprayoon C. Nonaspirin Nonsteroidal Anti-Inflammatory Drugs and Risk of Hemorrhagic Stroke: A Systematic Review and Meta-Analysis of Observational Studies. Stroke. 2016 Feb;47(2):356-64
- Fosbøl EL, Olsen AM, Olesen JB, Andersson C, Kober L, Torp-Pedersen C, et al. Use of nonsteroidal anti-inflammatory drugs among healthy people and specific cerebrovascular safety. Int J Stroke. 2014 Oct;9(7):943-5
- Battistella M, Mamdami MM, Juurlink DN, Rabeneck L, Laupacis A. Risk of upper gastrointestinal hemorrhage in warfarin users treated with nonselective NSAIDs or COX-2 inhibitors. Arch Intern Med. 2005 Jan 24;165(2):189-92
- Malhi H, Atac B, Daly AK, Gupta S. Warfarin and celecoxib interaction in the setting of cytochrome P450 (CYP2C9) polymorphism with bleeding complication. Postgrad Med J. 2004 Feb;80(940):107-9
- Dentali F, Douketis JD, Woods K, Thabane L, Foster G, Holbrook A, et al. Does celecoxib potentiate the anticoagulant effect of warfarin? A randomized, double-blind, controlled trial. Ann Pharmacother. 2006 Jul-Aug;40(7-8):1241-7
- Chung L, Chakravarty EF, Kearns P, Wang C, Bush TM. Bleeding complications in patients on celecoxib and warfarin. J Clin Pharm Ther. 2005 Oct;30(5):471-7
- Jia Z, Zhang Y, Ding G, Heiney KM, Huang S, Zhang A. Role of COX-2/mPGES-1/prostaglandin E2 cascade in kidney injury. Mediators Inflamm. 2015;2015:147894
- Ungprasert P, Cheungpasitporn W, Crowson CS, Matteson EL. Individual non-steroidal anti-inflammatory drugs and risk of acute kidney injury: A systematic review and meta-analysis of observational studies. Eur J Intern Med. 2015 May;26(4):285-91
- Bouvy ML, Heerdink ER, Hoes AW, Leufkens HG. Effects of NSAIDs on the incidence of hospitalisations for renal dysfunction in users of ACE inhibitors. Drug Saf. 2003;26(13):983-9
- Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med. 2000 Nov 23;343(21):1520-8, 2 p following 1528
- Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A, et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the CLASS study: A randomized controlled trial. Celecoxib Long-term Arthritis Safety Study. JAMA. 2000 Sep 13;284(10):1247-55
- Jüni P, Rutjes AW, Dieppe PA. Are selective COX 2 inhibitors superior to traditional non steroidal anti-inflammatory drugs? BMJ. 2002 Jun 1;324(7349):1287-8
- Laine L. Gastrointestinal safety of coxibs and outcomes studies: what's the verdict? J Pain Symptom Manage. 2002 Apr;23(4 Suppl):S5-10; discussion S11-4
- Scheiman JM, Herlitz J, Veldhuyzen van Zanten SJ, Lanas A, Agewall S, Nauclér EC, et al. Esomeprazole for prevention and resolution of upper gastrointestinal symptoms in patients treated with low-dose acetylsalicylic acid for cardiovascular protection: the OBERON trial. J Cardiovasc Pharmacol. 2013 Mar;61(3):250-7
- Melcarne L, García-Iglesias P, Calvet X. Management of NSAID-associated peptic ulcer disease. Expert Rev Gastroenterol Hepatol. 2016 Jun;10(6):723-33
- Massó González EL, Patrignani P, Tacconelli S, García Rodríguez LA. Variability among nonsteroidal antiinflammatory drugs in risk of upper gastrointestinal bleeding. Arthritis Rheum. 2010 Jun;62(6):1592-601
- Sostres C, Gargallo CJ, Lanas A. Nonsteroidal anti-inflammatory drugs and upper and lower gastrointestinal mucosal damage. Arthritis Res Ther. 2013;15 Suppl 3:S3
- Nissen SE, Yeomans ND, Solomon DH, Lüscher TF, Libby P, Husni ME, et al. Cardiovascular Safety of Celecoxib, Naproxen, or Ibuprofen for Arthritis. N Engl J Med. 2016 Dec 29;375(26):2519-29
- Chan FK, Wong VW, Suen BY, Wu JC, Ching JY, Hung LC, et al. Combination of a cyclo-oxygenase-2 inhibitor and a proton-pump inhibitor for prevention of recurrent ulcer bleeding in patients at very high risk: a double-blind, randomised trial. Lancet. 2007 May 12;369(9573):1621-6
- Teerawattananon C, Tantayakom P, Suwanawiboon B, Katchamart W. Risk of perioperative bleeding related to highly selective cyclooxygenase-2 inhibitors: A systematic review and meta-analysis. Semin Arthritis Rheum. 2017 Feb;46(4):520-528
- Gobble RM, Hoang HL, Kachniarz B, Orgill DP. Ketorolac does not increase perioperative bleeding: a meta-analysis of randomized controlled trials. Plast Reconstr Surg. 2014 Mar;133(3):741-55
- Kelley BP, Bennett KG, Chung KC, Kozlow JH. Ibuprofen May Not Increase Bleeding Risk in Plastic Surgery: A Systematic Review and Meta-Analysis. Plast Reconstr Surg. 2016 Apr;137(4):1309-16
- Riggin L, Ramakrishna J, Sommer DD, Koren G. A 2013 updated systematic review & meta-analysis of 36 randomized controlled trials; no apparent effects of non steroidal anti-inflammatory agents on the risk of bleeding after tonsillectomy. Clin Otolaryngol. 2013 Apr;38(2):115-29
- Stiller CO, Hjemdahl P. Lessons from 20 years with COX-2 inhibitors: importance of dose-response considerations and fair play in comparative trials. J Intern Med. 2022 May 18. doi: 10.1111/joim.13505
Senast ändrad
